6: Emulgatorer - hvorfor er de nødvendige?
Hvilke væsker kan blandes?
Olivenolie er ikke blandbart med vand, derimod kan ethanol blandes med vand i alle forhold. Hvis vi skal forstå, hvorfor det forholder sig sådan, må vi se nærmere på opbygningen af vandmolekylet og molekylerne i fedtstoffer eller spiseolier.
I vandmolekylet ligger de tre atomer i H2O ikke på linje, men danner en vinkel som vist på figurerne.
 |
 |
 |
 |
Mellem O-atomet og hvert H-atom er der en elektronparbinding (kovalent binding). Det fælles elektronpar, som udgør en enkeltbinding i molekylet, fordeles ikke ligeligt mellem O- og H-atomet. Oxygenatomet trækker mere end hydrogenatomet i det fælles elektronpar mellem de to atomer. Herved bliver en større del af den fælles elektronsky trukket over mod oxygenatomet.
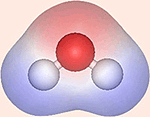
Da elektronskyen er negativ, får O-atomet et lille overskud af negativ ladning, δ– (delta minus). H-atomet mister derimod en del af det fælles elektronpar og bliver svagt positivt ladet, δ+ (delta plus).
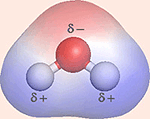
Oxygensiden af vandmolekylet er negativ, og et punkt midt mellem H-atomerne er center for en svag positiv ladning. Da centeret for positiv og negativ ladning i molekylet ikke er sammenfaldende, er molekylet polært.
Da vandmolekyler er polære og samtidig små, kan hydrogenatomet i et vandmolekyle tiltrække elektroner fra et O-atom i et nabomolekyle. Derved kommer hydrogenatomet til at danne bindinger mellem vandmolekylerne. Disse bindinger kaldes hydrogenbindinger.
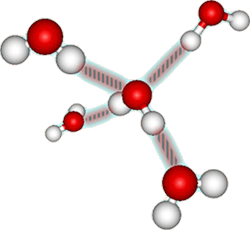
Da vandmolekylet er et polært molekyle, kaldes vand et polært opløsningsmiddel.
Andre molekyler, fx alkoholer, indeholder også et hydrogenatom, der er bundet til et oxygenatom, altså atomgruppen –OH. Grupper, der ligesom –OH kan danne hydrogenbindinger, kaldes hydrofile grupper.